Alzheimer : l’UE autorise Kisunla d’Eli Lilly pour les premiers stades, sous conditions
Approbation européenne et cadre d’utilisation
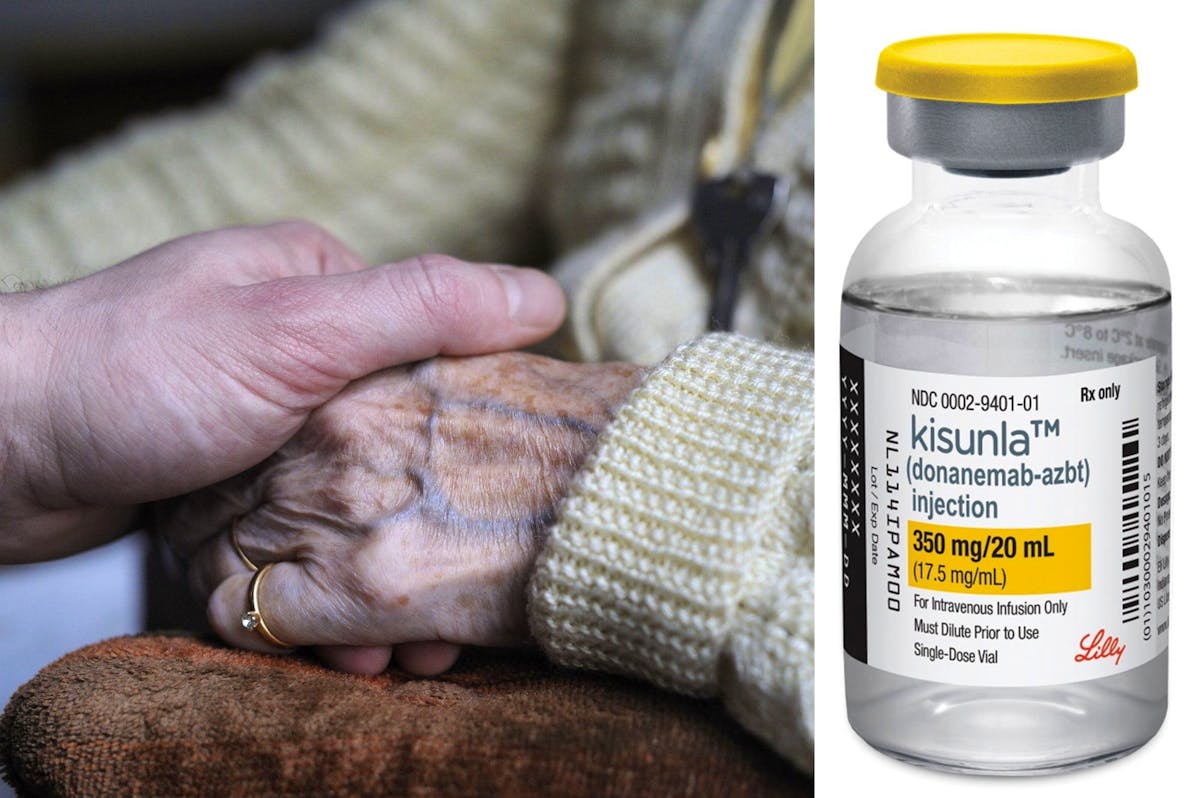
La Commission européenne a autorisé la commercialisation du Kisunla, médicament fondé sur la molécule donanemab et développé par Eli Lilly, pour traiter des déficiences cognitives légères et une démence au stade précoce de la maladie d’Alzheimer, dans un cadre strict.
Un duo de traitements en débat
Avec Leqembi (lecanemab) des sociétés Biogen et Esai, Kisunla constitue l’une des principales innovations récentes dans le domaine des traitements anti-Alzheimer. Si les essais cliniques ont montré des résultats marquants après des décennies de recherches, l’ampleur des bénéfices réels demeure discutée et les risques potentiels inquiètent certains spécialistes.
Ces traitements peuvent entraîner des effets secondaires graves, parfois mortels, notamment des hémorragies et des œdèmes cérébraux.
Conditions d’accès et précautions
L’autorisation européenne est conditionnée à l’accès des patients en début de maladie et à l’absence de mutations génétiques augmentant les risques d’effets secondaires.
Le Kisunla ne peut être prescrit que dans ce stade précoce et chez les patients qui ne présentent pas ces mutations.
Remboursement et positionnement international
À la fin 2024, l’UE avait déjà approuvé Leqembi après un refus initial et a suivi le même raisonnement pour Kisunla, laissant une marge de manœuvre aux États membres en matière de remboursement dans un cadre réglementaire.
En France, début septembre, l’évaluation du remboursement accéléré pour Leqembi n’a pas été retenue, sans exclure une révision ultérieure à plus long terme.
Réactions et situation hors de l’UE
Hors de l’Union européenne, le Royaume-Uni a autorisé ces traitements mais ne les rembourse pas, jugeant le coût élevé par rapport à des bénéfices jugés modestes. Aux États-Unis, les traitements bénéficient d’une approbation, mais leur remboursement dépend largement des assurances privées.